
6月17日��,我校華西生物治療全國重點實驗室/beat365鈕大文教授團隊聯(lián)合北京大學深圳研究生院吳云東教授在Nature發(fā)表題為“Catalytic Glycosylation for Minimally Protected Donors and Acceptors”的研究文章���。研究開發(fā)了一個通用平臺,用于未保護或受保護程度極低的供體和受體之間進行位點�����、立體和化學選擇性O-糖基化反應。這項研究利用催化劑實現(xiàn)了高選擇性糖基化反應����,為糖化學領(lǐng)域中“選擇性控制”這一長期挑戰(zhàn)帶來了全新思路��,有望極大降低糖類化合物合成的難度����,為探索糖類化合物的功能提供技術(shù)支撐,代表了糖化學領(lǐng)域的重大進展�。
四川大學為第一通訊單位,生物治療全國重點實驗室博士生黨湫菂���、北京大學深圳研究生院博士生鄧逸輝為共同第一作者�,鈕大文教授和吳云東教授為共同通訊作者�����。
糖被稱為第三生命鏈,在生理病理過程��、重大疾病診斷��、小分子藥物研發(fā)�、大分子靶向藥物遞送���、免疫治療等領(lǐng)域都發(fā)揮著不可或缺的作用。要研究和開發(fā)糖的功能�,亟需高效、簡潔的方法對這些結(jié)構(gòu)復雜的分子進行化學合成�。然而,由于糖類結(jié)構(gòu)復雜�����,具有多個手性中心和羥基�����,如何實現(xiàn)選擇性控制是糖類合成長期面臨的挑戰(zhàn)��。多年來��,化學家們一般通過繁瑣的“保護基”操作來控制O-糖苷化過程中的選擇性����,這極大地增加了合成工作的復雜性。而如何擺脫保護基的依賴�,實現(xiàn)糖苷鍵直接高效、高選擇性構(gòu)建,是該領(lǐng)域長期懸而未決的科學難題���。
研究團隊設想通過催化劑控制策略來實現(xiàn)未保護糖之間的精準O-糖苷化�����。在前期工作中�,團隊建立了通過自由基策略將穩(wěn)定易得的烯丙基糖基砜轉(zhuǎn)化為活性糖基親電試劑的方法(圖中1到2過程)����。這個糖供體活化策略已被證明能夠兼容包括游離羥基在內(nèi)的大多數(shù)極性官能團����,為開發(fā)不依賴保護基的催化體系提供了可能。團隊進一步設想設計催化劑(圖中4)將原位產(chǎn)生的親電糖供體2和糖受體5通過可逆相互作用(如多個非共價和可逆共價作用)組裝在一起�,像酶催化過程一樣限制底物的運動自由度,實現(xiàn)未受保護的糖受體和供體間選擇性O-糖苷化���。
基于這一設想�����,研究團隊設計開發(fā)了一類氨基硼酸催化劑����,通過與糖的非共價氫鍵和可逆共價B-O鍵的相互作用,結(jié)合自由基活化烯丙基糖基砜形成糖基溴化物的策略�����,實現(xiàn)了不依賴保護基的選擇性O-糖苷化�。此外,通過調(diào)控氨基硼酸催化劑的結(jié)構(gòu)���,能夠精準調(diào)控O-糖苷化的位置選擇性��。
該研究項目實驗部分由鈕大文教授團隊完成��,計算部分由吳云東教授團隊完成����;并得到了國家自然基金委優(yōu)青項目和創(chuàng)新群體項目���、四川大學科研院創(chuàng)新領(lǐng)軍人才項目����、四川大學華西醫(yī)院1?3?5計劃項目的支持�。部分實驗分析測試在四川大學分析測試中心王曉燕老師和四川大學生命科學學院質(zhì)譜中心王晞華老師幫助下完成���。
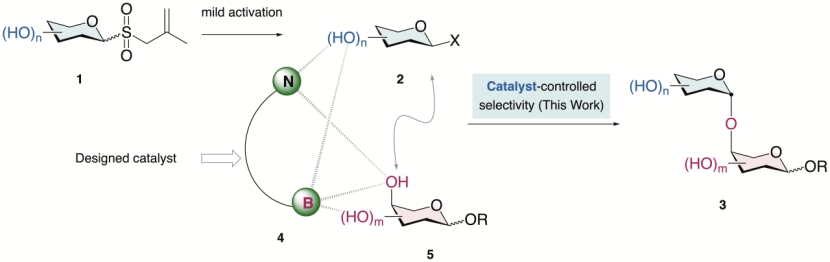
圖. a) 低聚糖合成背景。b) 反應設計���。
論文鏈接:https://www.nature.com/articles/s41586-024-07695-4

